自闭症谱系障碍(Autism spectrum disorder,ASD)是一种与行为异常相关的神经发育疾病,其表现包括社会缺陷、语言和智力障碍、坚持相同、感觉异常和刻板的行为模式增加[1-3]。遗传易感个体是否以及在多大程度上发展为ASD受到环境因素的影响,有具有密切相似遗传背景的亲属在他们发展为ASD症状的程度上可能有很大的不同[1-3]。鉴于ASD易感的多基因基础最为复杂,环境中可能会影响ASD发生的具体因素也尚不清楚,因此阐明环境因素对ASD发生的影响具有重要的治疗意义。
最近瑞士弗里德里希·米歇尔研究院的Pico Caroni课题组在Neuron上发表了题为Absence of familiarity triggers hallmarks of autism in mouse model through aberrant tail-of-striatum and prelimbic cortex signaling的文章,阐明了行为疗法对自闭症治疗的有效性[4]。
为了研究经历情境和ASD参与程度之间的可能关系,研究者们首先比较了WT和Shank3ΔC/ΔC小鼠在情境相关的社交/物体交互任务。他们所采用的行为学范式如图1所示,并测试小鼠的社交记忆和物体记忆。在1h时短期记忆测试实验中, Shank3ΔC/ΔC小鼠的表型和WT小鼠类似。但在24h时记忆测试实验中,Shank3ΔC/ΔC小鼠并没有表现出对陌生小鼠和新物体探索的增加(图1A、B)。这说明Shank3ΔC/ΔC小鼠可能存在长期记忆缺陷。
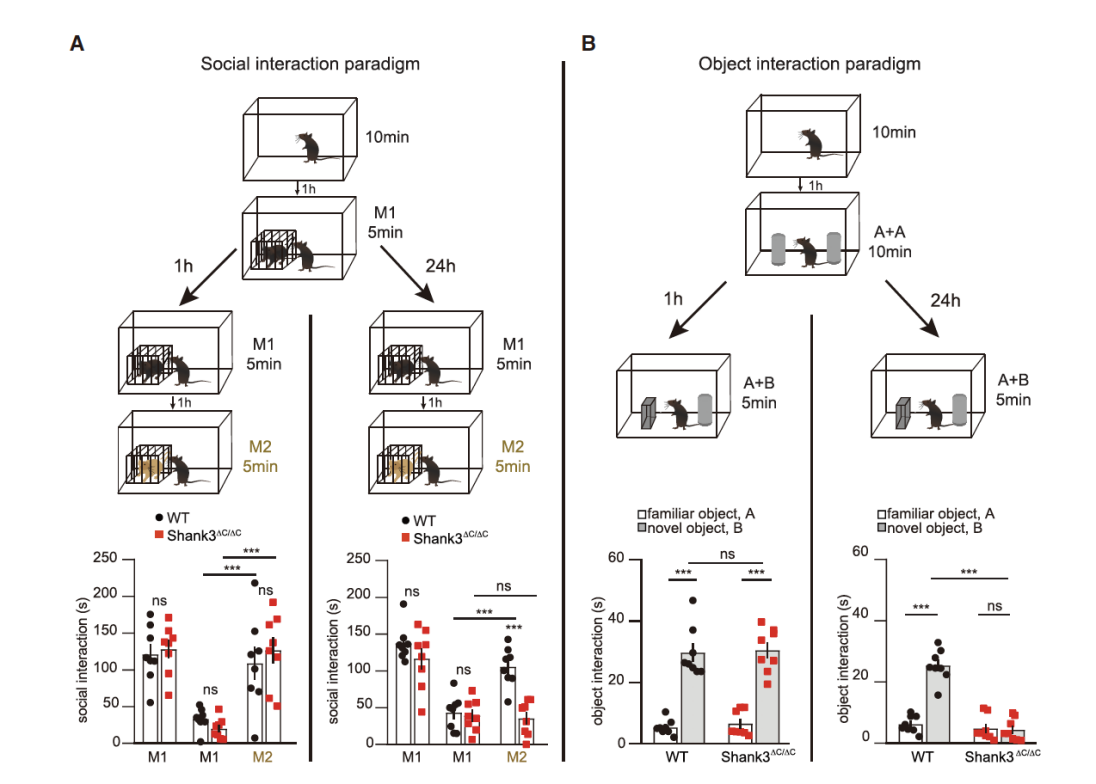
图1:社交/物体记忆行为学范式及结果
接下来研究者们探究了将小鼠暴露在新环境中是否会影响其对环境中物体的探索。结果显示在没有环境前暴露的情况下,WT和Shank3ΔC/ΔC小鼠在相同的新环境中对物体探索的表现相似(图2A)。第二天将Shank3ΔC/ΔC小鼠处于前一天探索过的环境中时,Shank3ΔC/ΔC小鼠的社交互动相较于WT小鼠显著减少(图2B),但其对未探索过环境的社交互动与WT无明显差异(图2C)。Shank3ΔC/ΔC小鼠的这种情境特异性社交障碍大约在初次进入新环境后12h出现,并持续至少1个月(图2D)。这说明Shank3ΔC/ΔC小鼠表现出长期的、情境特异性障碍。
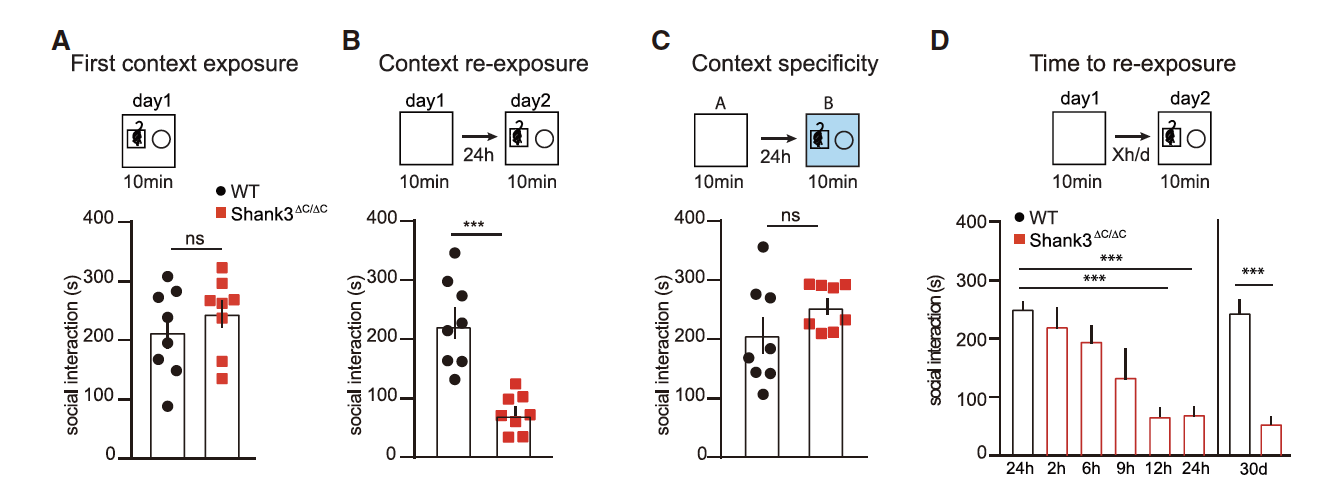
图2: 小鼠表现出情境特异性社交障碍
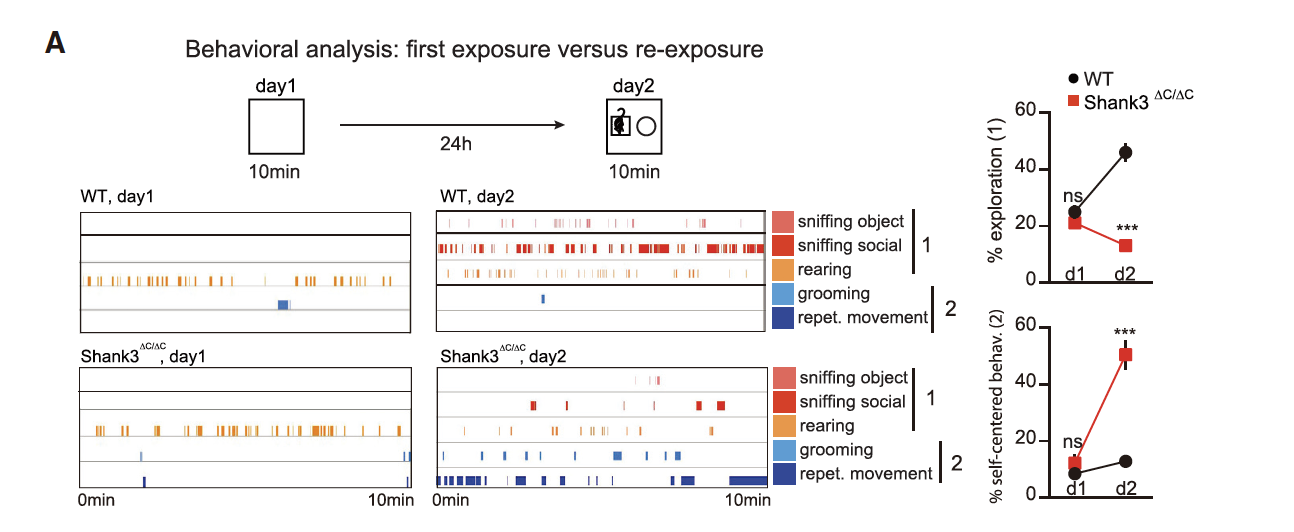
为了确定Shank3ΔC/ΔC小鼠可能出现的环境特异性行为异常,研究者们对Shank3ΔC/ΔC小鼠初次环境暴露和再次暴露时的行为进行了密切的观察。结果发现在24h后重新暴露于旧环境中时,Shank3ΔC/ΔC小鼠的探索行为显著减少,自我为中心的行为显著增加(图3A)。其中ASD的核心特征“重复性动作”在Shank3ΔC/ΔC小鼠再次环境暴露时显著增加。
为什么Shank3ΔC/ΔC小鼠这种环境特异性行为异常背后的神经环路机制是怎样的呢?研究者们将目光投向了纹状体。研究者们发现在通过化学手段(注射6-羟多巴胺)损伤纹状体尾部(Tail of striatum,TS)时,Shank3ΔC/ΔC小鼠在此暴露于环境中时的社交行为恢复到了正常水平,且其对新物体的探索时间明显增加(图4A)。这说明TS参与环境特异性的行为调控。
接下来研究者们又对TS区多巴胺(dopamine,DA)的释放进行了观察。他们将AAV9-hSyn-dLight1.3b病毒特异性注射到TS区(DA特异性荧光传感器),并观察小鼠与新物体交互时DA的分泌。结果发现Shank3ΔC/ΔC小鼠在靠近和离开物体时,其TS区DA的分泌远高于对照组(图4B),且在TS区注射D1/5R拮抗剂时,Shank3ΔC/ΔC小鼠的异常行为得到恢复(图4C)。这些结果说明在Shank3ΔC/ΔC小鼠暴露于探索过的环境时,DA释放增多引起TS的记忆导致再次暴露时参与性降低。
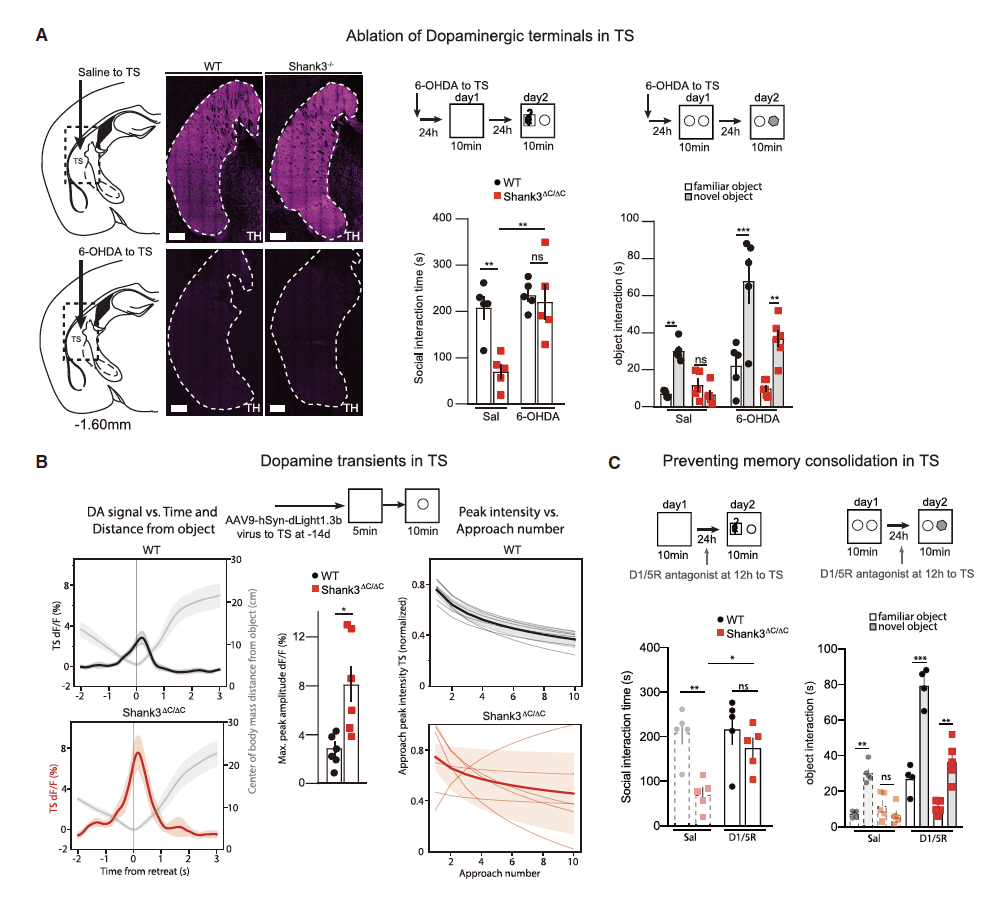
图4:TS区DA释放异常引起其环境特异性记忆障碍
第一次暴露时WT小鼠TS区也存在DA的释放,但其在再次暴露时仍具有探索的能力。为了解释这个现象,研究者们假设第一次暴露引起的TS相关回避可能会被来自其他脑区的输入抵消。于是他们通过逆向病毒示踪的方式将RetroAAV-Ef1a-mCherry-IRES-Cre注射至TS区,发现除了感觉和运动区外,内侧前额叶皮层(medial prefrontal cortex,mPFC)的PreL区和前扣带皮层(anterior cingulate cortex,ACC)以及杏仁核基地外侧区(basolateral amygdala ,BLA)都存在至TS区的神经投射(图5A、B)。
基于这些,研究者们想进一步确定抑制ASD相关的前额叶脑区是否会影响小鼠再次暴露于环境时的探索行为。他们借助化学遗传学的方式对PV-Cre小鼠的PreL、ACC和BLA区分别注射rAAV9-CBA-flox-PSAM抑制PreL、ACC和BLA的神经元活动。结果发现只有在抑制PreL区时,再暴露的PV-Cre小鼠和WT小鼠才表现出了社交异常(图6A、B)。当在PreL区注射AAV9-CBA-FLEX-PSAM激活神经元时,WT小鼠和Shank3ΔC/ΔC小鼠再暴露时的社交行为明显恢复(图6C)。这些loss-of-function和gain-of-function的实验说明在环境再暴露时Shank3ΔC/ΔC小鼠PreL -> TS神经元活动被抑制,导致其环境特异性记忆受损。
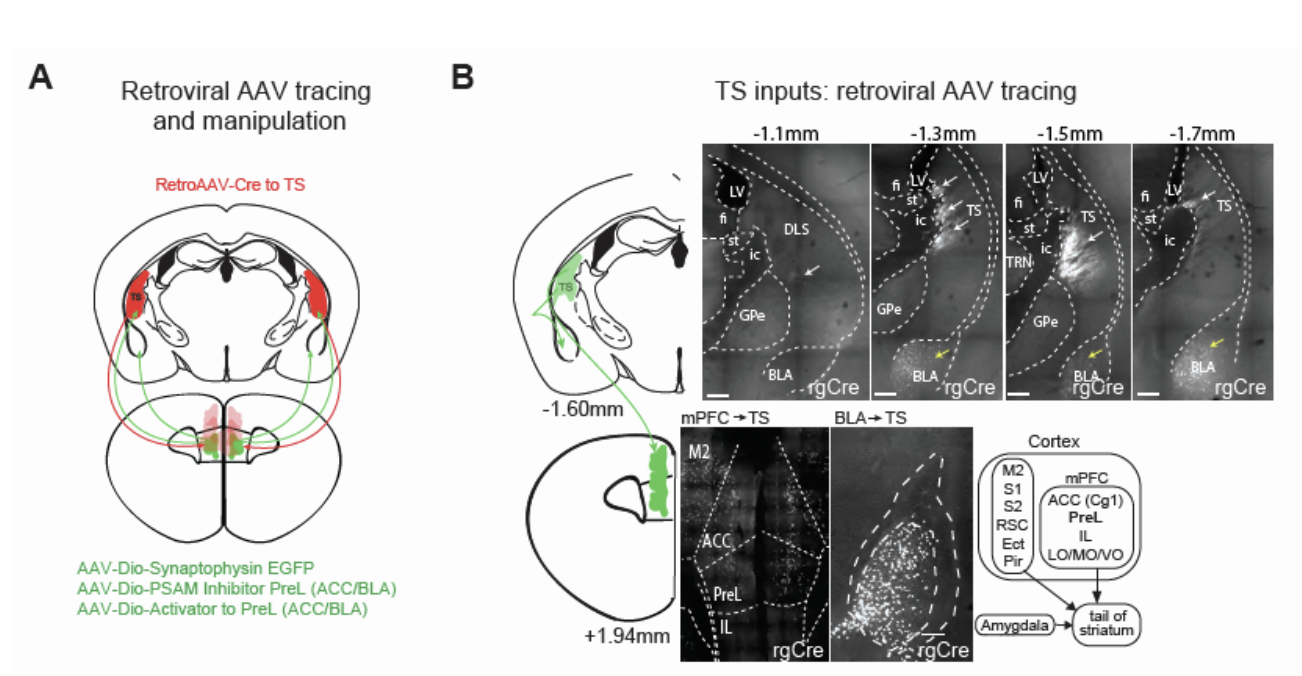
图5:逆向病毒示踪标记TS区上游脑区
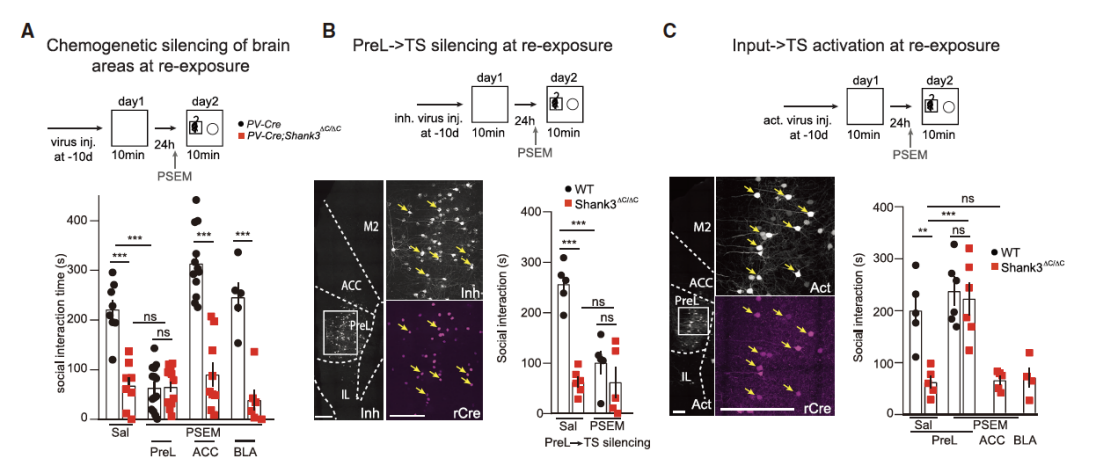
图6:再暴露时小鼠行为依赖于PreL -> TS的神经投射
目前为止,缓解ASD患者症状的成功方法包括各种形式的社会和环境干预(envirnmental enrichment,EE),但这种干预提高ASD患者社交能力的机制并不清楚。为了探讨这种模型的影响,研究者们对WT小鼠和Shank3ΔC/ΔC小鼠进行了为期三周的EE(图7A),并观察了在缺乏熟悉对象或物体的情况下,它对特定情境参与性的影响。结果发现经历过EE的Shank3ΔC/ΔC小鼠对新物体的探索时间明显增多,且EE时间越长,其参与程度越好(图7B、C)。为了进一步确定EE对PreL神经元的影响,研究者们同样通过化学遗传学的方式向PerL注射rAAV9-CBA-flox-PSAM并抑制其神经元活动。结果发现在初次暴露和二次暴露时,抑制PerL神经元后EE组的Shank3ΔC/ΔC小鼠社交行为都没有受到影响(图7E、F)。这说明EE可以通过避免PreL -> TS的神经投射挽救Shank3ΔC/ΔC小鼠的ASD样表型。
总之,这项工作发现Shank3ΔC/ΔC小鼠暴露在缺乏熟悉特征的新环境中会导致长期的参与失败和重复行为。在第一次暴露于环境中时加入熟悉的特征可以防止TS多巴胺瞬变增强,并使其与环境的交互恢复至正常水平。在野生型小鼠中,再次环境暴露的参与依赖于PerL -> TS的神经投射,而在Shank3ΔC/ΔC小鼠中,PreL -> TS投射受抑制,激活该环路可使小鼠的ASD症状得到缓解。因此,在遗传易感小鼠中,新环境在触发ASD样表型中具有关键作用,而涉及熟悉和丰富的行为疗法可能会阻止ASD表型的出现。
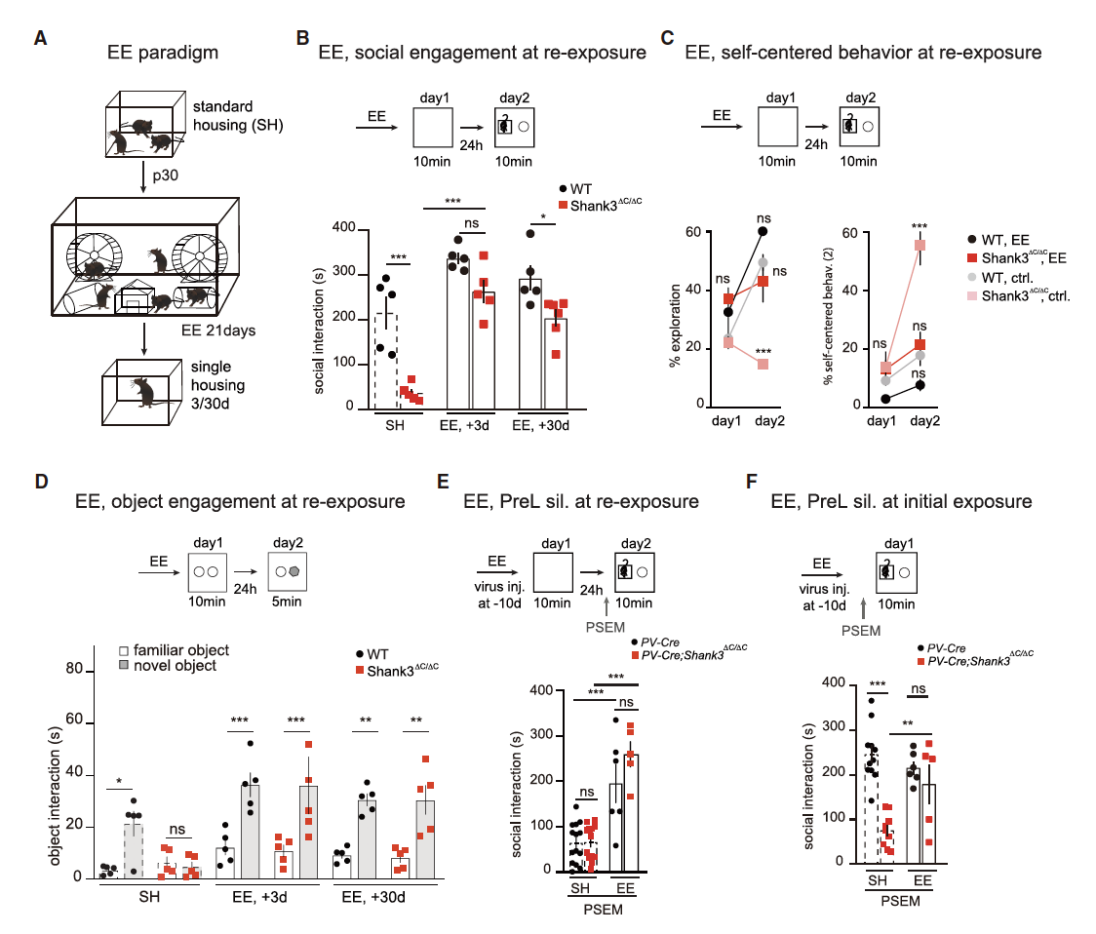
图7:EE可缓解ASD表型

病毒实验帮 公众号底部菜单栏【新功能】上线!
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
参考文献…
[1]Bourgeron T. From the genetic architecture to synaptic plasticity in autism spectrum disorder [J]. Nat Rev Neurosci, 2015, 16(9): 551-63.
[2]Baron-Cohen, S., and Belmonte, M.K. (2005). Autism: a window onto the development of the social and the analytic brain. Annu. Rev.Neurosci. 28,109–126.
[3]Jiujias, M., Kelley, E., and Hall, L. (2017). Restricted, repetitive behaviors in autism spectrum disorder and obsessive-compulsive disorder: a comparative review. Child Psychiatr. Hum. Dev. 48, 944–959.
[4] Kruttner S, Falasconi A, Valbuena S, et al. Absence of familiarity triggers hallmarks of autism in mouse model through aberrant tail-of-striatum and prelimbic cortex signaling [J]. Neuron, 2022
