
编者按
原发性脑肿瘤是起源于中枢神经系统细胞的一组异质性肿瘤,常见的恶性原发性脑肿瘤患者的治愈率和存活期均较低,其治疗手段和治疗效果也相当有限。因此,需要构建合适的肿瘤模型来研究疾病的分子生物学基础、新型抗肿瘤药物和/或治疗方法的临床前药效学和安全性评价。
今天,我们分享2023年由中国食品药品检定研究院国家药物安全评价监测中心、药物非临床安全评价研究北京市重点实验室研究团队发表的一项研究进展综述,该文总结了原发性脑肿瘤体内和体外模型的研究进展。体外模型主要包括脑肿瘤细胞株培养、类器官培养以及脑切片模型;体内模型主要包括啮齿类动物模型以及其他模式生物如果蝇、斑马鱼。目前已经开发了许多各具优缺点的原发性脑肿瘤疾病模型,但这些模型尚不能完全模拟人体内脑肿瘤的复杂情况,因此研究者们也在现有基础上不断开发更加复杂的疾病模型,用于研究原发性脑肿瘤的治疗、药物筛选和评价等。
文章题目
原发性脑肿瘤的临床前疾病模型研究进展
杂志:中国新药杂志
发表时间:2023年第32卷第8期
作者:梁志远、黄芝瑛、耿兴超、林志、屈哲等
单位:中国食品药品检定研究院国家药物安全评价监测中心/药物非临床安全评价研究北京市重点实验室;中山大学药学院等
01、研究背景
原发性脑肿瘤是指因中枢神经系统(Central Nervous System,CNS)内细胞癌变导致的一大类癌症,含有超过100种组织病理学上截然不同的子类,每种子类的流行病学、临床特征、治疗方法以及疾病终点都不尽相同。
最常见的原发性脑肿瘤是神经胶质瘤、脑膜瘤、垂体腺瘤、听神经瘤、淋巴瘤原发性中枢神经系统和原始(髓母细胞瘤)神经外肝层肿瘤。根据WHO于2020年的统计,185个国家原发性脑肿瘤的发病率在所有癌症中仅占1.6%(308102例)。但因为有血脑屏障(Blood-brain barrier, BBB)的存在,化疗药物很难通过循环系统进入病址,导致对原发性脑肿瘤的治疗收效甚微。一旦被发现患有脑肿瘤,患者的负担会显著提升,并且脑肿瘤具有较高的致死率。据报道,在被诊断惠有恶性脑肿瘤的患者中,仅有1/3能够存活5年以上。
因此,为了延长脑肿瘤患者的存活时间、提高患者生活质量,需要对原发性脑肿瘤进行基础的生物学研究以及开发相应的治疗手段,而这些研究离不开原发性脑肿瘤疾病模型的构建和开发。
理想的原发性脑肿瘤疾病模型应具备以下特征:基因背景与人的脑肿瘤相似;肿瘤微环境(tumor microenvironment,TME)与人的脑肿瘤内微环境相似;与人的脑肿瘤具有类似的异质性;造模程序标准化且具有重现性;经济实用等。
本综述将从体外模型、体内模型这两方面阐述原发性脑肿瘤模型的研究进展,详细阐述各类原发性脑肿瘤模型的构建方法、应用领域以及优缺点。
02、研究成果
1. 原发性脑肿瘤的体外模型
原发性脑肿瘤的体外模型相较于体内模型来说,能够通过调整肿瘤的外环境来探究疾病的分子机制,甚至还可以通过添加免疫细胞来探究TME 的状况。常见的原发性脑肿瘤体外模型有脑肿瘤细胞株培养、3D类器官培养以及器官型脑切片培养型等。
1. 1 脑肿瘤细胞株模型
脑肿瘤细胞株培养的原发性脑肿瘤模型不常用,其通常是培养单层的肿瘤细胞,如大鼠脑胶质瘤C6细胞、大鼠胶质肉瘤9L细胞、人脑星形胶质母细胞瘤U-87 MG、人源的原发性脑肿瘤细胞等,通常用来探究脑肿瘤内的分子变化、原发性脑肿瘤细胞的迁移能力、用于组织病理学鉴定和免疫细胞化学分析等。
而为了进一步探究TME的作用,可以在培养其他神经细胞时直接加入肿瘤细胞或使用培养肿瘤细胞的Transwell小室等方法来进行探究。脑肿瘤细胞株模型操作简便并且相当经济,但是却不能展现出完整的病理进程及TME在其中的作用,因此需要研究功能较为完善的模型来进行临床前研究。
1. 2 类器官培养模型
类器官培养模型相较于脑肿瘤细胞株模型而言,其特征更加接近机体的病生理环境。从比较简单的原发性脑肿瘤细胞成球,到比较前沿的原发性脑肿瘤类器官模型,跨度较大,包含的特点也从简单到复杂。
较为简单的原发性脑肿瘤类器官模型,通过使用悬滴法等培养方法,将人神经胶质瘤细胞等脑肿瘤细胞培养成球,得到类器官模型,其异质性与实际上的人神经胶质瘤相似,并且在组织病理学上具有类似的细胞分布、缺氧核心及梯度分布的细胞代谢物。这种简单的类器官模型,可以作为体外的疾病模型或用于药物筛选。
而为了进一步体现TME的复杂性,研究人员在成球阶段使用含有巨噬细胞以及脑肿瘤细胞的细胞混悬液或使用含有神经小胶质细胞及脑肿瘤细胞的细胞混悬液,来探究多种细胞之间的相互作用。通过这些研究,发现了巨噬细胞在共同成球后,会分泌出白介索-10 (interleukin 10,IL-10)和表皮细胞生长因子(Epidermal Growth Factor,EGF),提高耗氧量,甚至产生对紫杉醇的抗药性;也发现了小胶质细胞在与脑肿瘤细胞成球后,会展现出一定的对神经胶质瘤细胞的细胞毒性。
还有用于研究肿瘤细胞转移能力的模型,研究者分离出脑肿瘤患者的细胞,并将其转化为诱导性多能干细胞(induced pluripotent stem cells,iPS cells),并在体外培养成大脑类器官后,再加入恶性神经胶质瘤细胞共培养,最终使用细胞成像技术来研究肿瘤细胞转移的能力。
而iPSC的使用也给相关研究带来想象空间,iPSC成为类大脑类器官后,可以选择加入巨噬细胞(之后会进一步转化为神经小胶质细胞),随后再加入患者的肿瘤干细胞和免疫细胞,从而使得整个环境更加接近机体的病生理状态。当然,到目前为止这种类器官模型也不能完全模拟真实情况下的TME情况,也排除了BBB对TME的影响,且技术上较为复杂。
1. 3 脑切片模型
脑切片模型较好地保留了脑组织的细胞结构,并且易于在培养皿上操作和观察。目前,脑切片模型的来源更多的是啮齿类动物,近些年来,也会更多地使用转基因啮齿类动物。
此外,还可以向脑切片模型中添加神经胶质瘤干细胞或原发性脑肿瘤细胞的球,通过观察神经胶质瘤干细胞的行为以及其与脑组织细胞的相互作用,探索肿瘤细胞在脑内迁移的机制,甚至可以将肿瘤细胞注射至特定的脑区,用以研究特定脑区的肿瘤病变。
另外,因为一个实验动物的大脑可以制作多个切片来研究不同的病变,脑切片模型还可以减少实验动物的使用。但是,该模型也并不是完美的,一般来说,脑切片模型在体外只能存活3周左右,不利于对进程较慢的原发性脑肿瘤的研究和长期用药的研究。此外,虽然保留了血管,但是由于其内部液体不流通,对免疫细胞募集到病变处有一定影响。
最后,因为需要将大脑切片,不可避免地诱发细胞死亡以及激活神经小胶质细胞导致炎症的产生,但可以通过使用脑切片内深处的细胞以避免炎症等导致的影响。
2. 原发性脑肿瘤的体内疾病模型
原发性脑肿瘤的体内疾病模型种类多样、各有优劣,其中最主要应用的是啮齿类动物模型。随着时间的推移,也开发出了新的模式动物,如果蝇和斑马鱼。
2. 1 原发性脑肿瘤的啮齿类动物模型
原发性脑肿瘤的啮齿类动物模型的种类繁多,但是大致可以分为同种异体原位移植模型、异种异体原位移植模型以及基因改造小鼠模型。
2.1.1 同种异体原位移植模型
同种异体原位移植模型,即将跟实验动物同种的脑肿瘤细胞株,通过立体定位手术转移至相应动物颅内形成的原发性脑肿瘤模型。常用的脑肿瘤细胞株有大鼠C6 神经胶质宿细胞株、大鼠9L神经胶质肉瘤细胞株、大鼠F98神经胶质瘤细胞株、小鼠 GL261神经胶质瘤细胞株等。这些细胞能够在相应实验动物大脑内的第四脑室、小脑或其他区域生长成瘤,形成研究者需要的原发性脑肿瘤模型。
这种构造模型办法的最大好处是实验动物具有完整的免疫能力,这对免疫治疗药物的评价非常重要。有研究通过RNA测序以及质谱流式细胞技术(Mass Cytometry,CyTOF)来快速确认不同小鼠恶性胶质瘤细胞株同种异体原位移植模型形成的恶性胶质瘤对免疫系统的反应强弱,能更好地选择用于恶性胶质瘤的免疫疗法的模型个体。除此以外,同种异体原位移植模型也能提供一些候选药物和疗法的相关信息。
有研究者使用大鼠F98神经胶质瘤细胞株造的神经胶质瘤模型,证明了神经干细胞和间充质干细胞能够作为基因治疗药物的载体,具有一定开发成治疗脑肿瘤的疗法的潜力。但是这种模型也有一定的缺陷:肿瘤细胞株会因为多次传代导致产生遗传偏移;同种异体原位移植模型缺乏实际脑肿瘤中逐步基因变化;有时候造特定模型时会因为脑肿瘤细胞没有进入脑实质而导致造模失败;其基因背景与人有差异。
2.1.2 异种异体原位移植模型
异种异体原位移植模型,即将人的神经胶质瘤细胞通过立体定位手术,转移至免疫抑制的啮齿类动物(如裸鼠)颅内而制造的模型。最常用的几种细胞分别是人脑星型母胶质细胞瘤U87、人神经胶质细胞瘤U251等,但是长期培养的细胞株会有基因偏移的现象,故也有研究者使用的是患者的脑肿瘤细胞。
这种模型在一定程度上能够具有血管再生和肿瘤转移的现象,但是也只维持了原发性脑肿瘤的部分组织病理学特性异质性和分子生物学特性。并且,由于使用的是免疫缺陷的动物,必须考虑这对肿瘤的免疫环境以及TME产生的影响。以裸鼠为例,裸鼠不能产生成熟的淋巴细胞,只能产生骨髓细胞(包括神经小胶质细胞),因此就缺乏了获得性免疫这一部分对原发性脑肿瘤的影响。而这也影响到了这种模型在药物研究方面的应用。
针对这样的缺陷,有研究者构建出人源化模型鼠。一般来说,构建模型鼠有3种:移植人外周血单核细胞(human Peripheral blood mononuclear cell,hu-PBMC)的具有高活性的T维胞,但是移植4~6周后会攻击宿主且其他免疫细胞功能不健全;移植人CD34造血干细胞则能够产生所有造血谱系的细胞;骨髓肝胸腺(bone marrow liver thymic,BLT)小鼠,就是将人胚胎的胸腺、肝脏和CD34细胞移植到目标小鼠内产生的模型,这种模型的免疫功能最为健全,但最终也会发生移植物抗宿主病。近些年发展出了能够表达人细胞因子的转基因小鼠,能够支持人源化小鼠构建更加完善的免疫系统,并延迟移植物抗宿主病的发生。
2.1.3 基因改造鼠模型
原发性脑肿瘤的另外一种模型即基因改造鼠模型,在使肿瘤发生的关键基因发生突变后,这种模型的颅内就会自发地发生病变,生成肿瘤。这种模型在一定程度上具有跟人相似的组织病理学特性和分子特征,并且其肿瘤能够逐步具有转移能力。根据不同的目的,可对不同的基因进行操控。
常见的模型如下:对Rtk基因、H3f3a基因、Hist1h3b基因、P53基因、Rb基因、Nf1基因以及跟细胞周期有关的基因等的1个或多个进行调控,可构造神经胶质瘤的模型;对P53基因和c-Myc基因共同调控,可构造脉络纵肿瘤;对ptch1基因、P53基因等进行调控,可以构造成神经管细胞瘤模型四;对Nf2基因、Cdkn2ab基因、Pdgf基因的1个或多个进行调控,可以构造脑膜瘤模型;对 P53基因和Rb基因共同调控,可以构造松果体母细胞瘤。
而随着时间发展,研究者已经能够通过调控基因表达来构建适合研究目的的基因改造小鼠模型,常见的方法有RCAS-tVA和Cre-LoxP重组酶系统。RCAS-tVA使用的是鸟类逆转录病毒(replication competent avian-like sarcoma virus,RCAS)以及其鸟类肿瘤病毒 A(tumor virus receptor-A,tVA),使用这种方法可以将肿瘤相关基因转入到表达tVA细胞内,一旦控制tVA的基因开始表达,RCAS识别后就会将相关基因转移到目标细胞中。
Connolly 等将大鼠的Nestin基因作为调控tVA表达的开关,并向大鼠注入携带血小板源性生长因子(platelet-derived growth factor,PDGF)和P53的短发夹 RNA(short hairpin RNA,shRNA)的RCAS,抑制了P53的同时使PDGF过表达,导致大鼠发生恶性胶质瘤;Cre-LoxP重组酶系统利用了Cre重组酶的特性,能够识别 LoxP位点,将目标基因嵌入同向的LoxP位点时,也会使其成环断开,从而切除LoxP 位点之间基因。Han等利用该技术在小鼠胚胎期时敲除了Smarcb1基因,构造出了各方面与人类相似的非典型畸胎样/横纹肌样瘤模型。
该模型也存在缺陷,首先是进行转基因改造的成本以及耗时都较大,其次是因为种类不同,构建的模型的脑肿瘤异质性、分子生物学特征等与人类有一定的差异。
2.2 其他原发性脑肿瘤体内模型
原发性脑肿瘤的啮齿类动物模型需要大量的资源以及时间投入,不利于使用高通量的方法来筛选药物,因此在该方面需要寻求另外的替代模型。而这时候,简单且基因更加可控的动物,如斑马鱼和果蝇便是较为理想的目标。
2.2.1 斑马鱼
斑马鱼是目前常用的实验动物之一,其与人类基因有87%的相似性,并且82%的人类疾病基因都能在斑马鱼上找到对应。此外,斑马鱼的呼吸系统、循环系统和中枢神经系统与人类相似且其基因操控相对便捷,十分适合用于原发性脑钟瘤的研究。
斑马鱼具有一个特性,其胚胎以及幼虫时均是透明的,可以实时观察肿瘤细胞渗透以及TME的情况。此外,斑马鱼的BBB在卵子受精后发育的d15才会成熟,这就意味着研究人员可以根据他们的研究目的来选择给药的时间,用于研究BBB成熟或不成熟下药物对脑肿瘤的治疗效果。
获得斑马鱼原发性脑肿瘤模型的方法一般有基因改造、移植这2种办法。Jung 等通过对Ptf1基因的调控来激活蛋白激酶B(protein kinase B, PKB),从而构造了位置在小脑的神经胶质瘤模型。此外,Ju等通过控制斑马鱼Gfap和Krt5基因的表达,构造出了神经鞘瘤模型。因为透明的特性,移植这一办法变得简单且高效,并且可以时刻观测肿瘤细胞的移植、生长以及转移等过程。Eden等将红色荧光蛋白基因转入到小鼠神经干细胞中,并将该细胞移植至斑马鱼幼虫内,产生的脑肿瘤具有主要的分子生物学特点以及组织病理学特点,并且可以通过红色荧光蛋白观察其转移。通过相同的办法,还可以构造出恶性胶质瘤模型、室管膜瘤模型以及脉络纵肿瘤模型。
2.2.2 果蝇
果蝇在遗传方面的研究中发挥着重要作用,在基因组上与人类十分相似,75%的人类疾病基因与果蝇同源,是构建人类疾病模型较为理想的动物,并且其生命周期只有10d,大大降低时间成本。
果蝇可以作为原发性神经胶质瘤模型。果蝇的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和表皮生长因子受体(Epidermal growth factor receptor, EGFR)与人类高度同源。Read 等同时激活PI3K 和EGFR的表达,使得果蝇的神经胶质细胞癌变,产生神经胶质瘤。果蝇也可用于研究神经胶质瘤的转移,Witte等通过上调胰岛素受体基因Pvr、Htl以及EGFR基因,得到了具有迁移性的果蝇神经胶质瘤模型。
总之,无论体外模型还是体内模型都试图更加接近人体原发性脑肿瘤的病生理状态,在此基础上开发出经济的、操作程序可控的、可长期培养/使用的实验模型至关重要,在这些模型的基础上,研究人员也揭示了原发性神经肿瘤的一些特异性靶点,并且研发出相应的治疗策略。然而,至今已应用的原发性脑肿瘤模型各具优缺点,见表1。因此,需要根据药物性质特征/不同靶点通路选择更加合适的疾病模型或模型组合、模型改造来更加全面、可靠的评价药物。
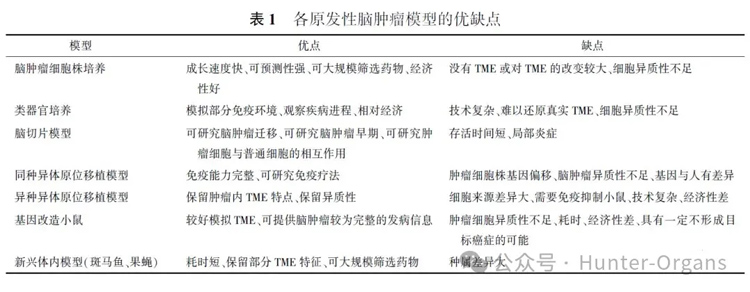
表1 各原发性脑肿瘤模型的优缺点
03、编者点评
目前,原发性脑肿瘤的体内以及体外模型已经揭示了在原发性脑肿瘤发病的过程中,细胞内的一系列分子生物学变化,这对于原发性脑肿瘤的治疗来说无疑是一笔巨大的财富。在前期研究的基础上,相关的药物也陆续被研发并处于临床阶段或上市,靶向神经胶质瘤内线粒体异柠檬酸脱氢酶(Mitochondrial isocitrate dehydrogenase,IDH)突变的恩西地平和艾伏尼布、靶向恶性胶质瘤检查点的纳武利尤单抗(NCT02667587)、使用基因改造的神经干细胞治疗恶性胶质瘤(NCT02192359)等。
根据这些模型得到的分子生物学信息,利用计算机辅助药物设计(computer-aided drug design,CADD)的方法,如分子动力学模拟、分子对接、定量构效关系等技术,来对一系列化合物进行虚拟筛选,最终得到能够通过BBB且具有一定效果的理想药物。
为了紧跟各类新型的治疗原发性脑肿瘤药物研发的脚步,研究者们仍需不断攻克各类原发性脑肿瘤体内外模型的缺陷,例如模型内原发性脑肿瘤的细胞异质性不如实际丰富、模型的TME环境与人类实际的TME环境有差别等,开发出更加完善的原发性脑肿瘤疾病模型,为临床前药效评价以及安全评价提供有效的研究模型。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
