腺相关病毒AAV简介
早期基因治疗曾尝试腺病毒载体,但因其免疫原性过强和导入的环状DNA可能在细胞分裂中丢失而被AAV取代。AAV是一种无包膜单链DNA病毒,属于细小病毒家族。AAV作为最早通过欧盟FDA认证的基因治疗载体,因其具有宿主范围广、非致病性、低免疫原性、长期稳定表达外源基因、良好的扩散性能和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验中。
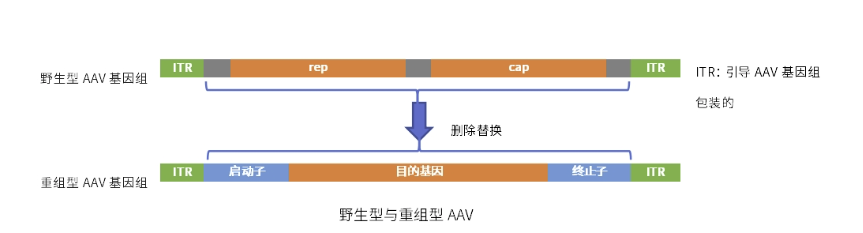
目前已发现AAV有12种亚型及120多种变型,并逐步用于基因药物研发。rAAV携带的蛋白衣壳与野生型AAV几乎完全相同,然而衣壳内的基因组中编码病毒蛋白的部分被删除,取而代之的是治疗性转基因(transgene)。
AAV基因组中唯一被保留的部分是ITRs,它起到指导基因组的复制和病毒载体组装的作用。将编码病毒蛋白删除,一方面可以最大化重组AAV携带转基因的容量,另一方面可以减小病毒载体的免疫原性和细胞毒性。
通常情况下AAV不能独立复制,只有在辅助病毒(如腺病毒、单纯疱疹病毒、痘苗病毒)存在时才能进行复制。
复制型腺相关病毒(rcAAV)概念及法规监管要求
在重组腺相关病毒(rAAV)载体生产过程中,转染用质粒DNA与rAAV会由于物理接近而导致rAAV载体基因组、Rep/Cap基因以及ITR序列发生非同源重组,这些重组序列被误包后就形成了具有复制能力的AAV,即复制型腺相关病毒(rcAAV)。
重组腺相关病毒载体收获液、纯化后的重组腺相关病毒原液、终产品等都可能有复制型腺相关病毒(rcAAV)的存在。rcAAV的存在可能不会引起rAAV产品的显著安全性风险,但是会增强或干扰治疗用rAAV 的作用效果或者导致rAAV载体基因序列的漂移 ,影响其基因组稳定性以及体内转导效率等。因此,规模化生产过程中监测和产品放行时检测rcAAV十分重要。
随着病毒载体在CGT领域应用越来越广泛,相关法规和技术原则对监测复制型病毒提出了建议。
·
CDE 2022年发布《体内基因治疗产品药学研究与评价技术指导原则(试行)》和《体外基因修饰系统药学研究与评价技术指导原则(试行)》都提到病毒载体制备工艺中,复制型病毒是安全性风险关注点之一,应采用经验证的方法开展检测,如指示细胞培养法、直接qPCR法等。
·
2020年11月欧洲的药品监管机构EMA也发布了指南“Guideline on quality,non- clinical and clinical aspects of medicinal products containing genetically modified cells”,要求从病毒载体的设计上应尽可能降低与野生型病毒相关的任何致病性,并尽可能将病毒重组和回复突变的风险降到最低,同时在产品的生产和应用的不同阶段进行RCL等的控制,以保障患者的用药安全。
·
2020年1月28日,FDA发布的《关于细胞与基因治疗申请(INDs)的化学、制造和控制(CMC)指导原则》中提到:对于复制型腺相关病毒rcAAV的检测,可以采用在辅助病毒存在的情况下扩增AAV,然后进行PCR检测rep/ITR序列,以及在对载体制备进行DNase消化后进行PCR检测rep和cap序列等。但该指导原则表明:不推荐用于检测rcAAV的特定方法,药企等应在IND中说明所用的检测方法和检测灵敏度。
·

复制型腺相关病毒(rcAAV)的检测
中美欧三国监管机构对于复制型病毒的控制阶段和检测要求基本相同,在产品生产的各个阶段以及在接受基于病毒载体的基因治疗的患者后续监测中进行检测。并且各监管机构推荐的复制型病毒的检测方法均是指示细胞培养法,该方法是复制型病毒检测的金标准。
复制型腺相关病毒(rcAAV)的形成主要归因于ITR中的同源序列和相邻序列与rep/cap元件之间可能出现的重组事件。目前,rcAAV检测常采用2种方法:基于细胞培养的检测方法和qPCR快检法(直接检测法)。
FDA的指导原则建议通过全面的质量研究确认产品的关键质量属性,由于下述rcAAV的两种检测方法各有优缺点,可考虑同时采用原理互补的不同方法进行研究。
//
基于细胞培养的检测方法
通过不断的细胞传代使rcAAV实现扩增,之后再利用qPCR或Southern-blot方法进行检测,保证检测到的rcAAV都具有复制能力,是目前最常用的检测方法。
但是该方法也有它的缺陷:检测灵敏度依赖于AAV不同血清型对靶细胞的感染效率,检测值可能低于实际值;培养方法和检测平台建立也有难度,需建易感细胞株、辅助病毒库等,耗时长且投入成本较高。
//
qPCR快检法(直接检测法)
对rAAV原液或终产品提取核酸后,直接利用qPCR法检测rcAAV,靶标基因一般为ITR、Rep、Cap等的连接序列,可实现对rcAAV上两种基因的检测,提高准确性。
其缺点为:检测片段短,不能保证检测目标具备rcAAV复制所需完整序列,导致检出的rcAAV不一定有复制能力,检测值相较实际值偏高。
因此,针对rcAAV的检测开发一款既能用于细胞培养后的终点检测,也能用于rcAAV直接检测的qPCR试剂盒,对于实现两种检测方法的互补验证非常有必要。
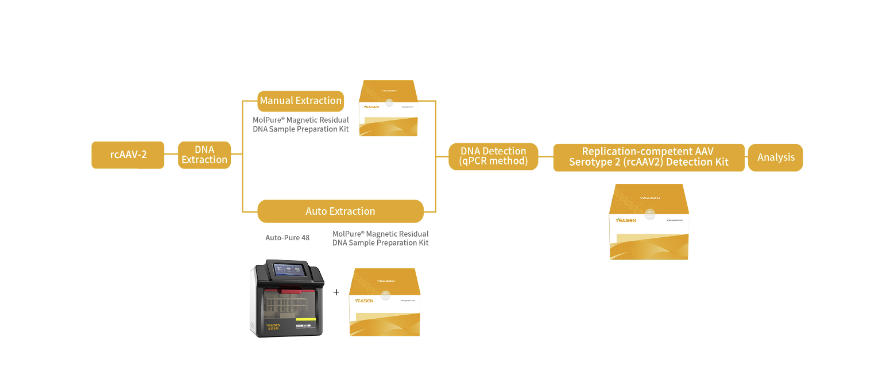
针对上述情况,翌圣生物自主研发了复制型腺相关病毒血清型2 (rcAAV2)检测试剂盒,基于荧光探针定量PCR原理,采用qPCR法分别检测rAAV末端重复序列(ITR)(即参考基因Reference)和rcAAV的连接序列(即靶基因Target),实现对rAAV和rcAAV的同时定量检测。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。用于定量分析检测各种使用AAV2血清型的重组腺相关病毒载体进行基因治疗、肿瘤治疗及疫苗研发等产品中可能发生的复制型腺相关病毒(rcAAV)的潜在风险。
//
产品资质
·
符合法规:按照EP2.6.7、JP G3和USP 63药典要求验证,符合国际权威机构的标准;
·
配合审计:产品生产符合ISO13485质量体系标准,有完善的审计文件;
·
保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定;
·
技术经验积累:TaqMan法有技术沉淀,使得Kit灵敏度高;
·
专注产品性能:Taq酶抗体库,双封闭抗体提高了Kit特异性、稳定性等。
·
//
产品特点
·
抗干扰性:针对复杂基质,样本加标回收率至少能达到70-130%;
·
灵敏度高:定量下限(LLOQ)为2copies/μL,检测下限(LLOD)为0.125copies/μL;
·
精密度高:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
·
·
专属性强:特异性检测目的基因序列,不受其他外源基因组DNA干扰;
·
·
防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等,避免假阴性。
·
验证完善:参考ICH Q2(R2)分析方法验证指导原则,可提供完善的验证报告。
·
//
验证内容
|
rcAAV-2检测验证项目 |
参考标准or要求 |
备注 |
|
|
1、试剂盒标准品(参考品) |
含有参考基因Reference和靶基因Target的质粒DNA |
|
|
|
2、线性范围 |
标曲范围 |
参考说明书或实际情况(Reference和Target均是2×101~2×106copies/μL) |
|
|
R2 |
≥0.98(P.s.本试剂盒≥0.99) |
药典要求 |
|
|
斜率 |
-3.1~-3.8(P.s.本试剂盒-3.1~-3.6) |
药典要求 |
|
|
扩增效率 |
90%~110%(P.s.对应的斜率-3.1~-3.6,行业内要求) |
|
|
|
3、准确性 |
回收率 |
50%~150%(P.s.本试剂盒70~130%) |
药典要求 |
|
4、精密度 |
重复性 |
CV<10% |
|
|
中间精密度 |
CV<15% |
|
|
|
5、专属性 |
不受其他来源基因组DNA的干扰 |
|
|
|
6、灵敏度 |
定量限 |
Reference和Target均是2copies/uL |
|
|
检测限 |
Reference和Target均是0.125copies/uL |
|
|
|
7、耐用性 |
仪器适用性 |
Thermo:ABI 7500、ABI QuantStudio5; Bio-Rad:CFX96 Optic Module; 上海宏石:SLAN-96S. |
|
|
8、稳定性 |
加速稳定性 |
37℃稳定14天,2~8℃稳定30天 |
|
|
反复冻融 |
≥10次 |
|
|
|
有效期 |
-25~-15℃保存2年 |
|
|
|
9、空白限 |
无模板对照(NTC) |
重复48次qPCR扩增曲线CT≥40 |
|
|
阴性抽提对照(NCS) |
重复48次qPCR扩增曲线CT≥40 |
|
|
//
产品信息
|
产品 |
货号 |
品名 |
规格 |
|
样本前处理 试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit 磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18467ES |
MolPure® Mag48 Sample Preparation Kit FN 磁珠法48孔样本前处理试剂盒FN(预封装) |
3×16T/ 6×16T |
|
|
核酸提取仪器 |
80511ES |
48通道自动化核酸提取仪 |
48通量 |
|
rcAAV-2检测试剂盒 |
41327ES |
Replication-competent AAV Serotype 2 (rcAAV2) Detection Kit 复制型腺相关病毒血清型2 (rcAAV2)检测试剂盒 |
50T/100T |
