CELLENION
自动化3D球体分拣、分离和分选
「 摘要」
spheroONE®是一种独特的大颗粒分离、分选和喷点仪器。该仪器结合了精密的低容量喷点、基于图像的玻璃喷点毛细管内颗粒跟踪和自动化功能,能够高效地分离和分拣球体、类器官和类肿瘤体等细胞聚集体。分离过程通常可在数分钟内将 92% 以上的单个球形颗粒分配到目标 96 孔板的每个孔中。此外,用户还可以随时定义分离参数(即颗粒的直径和伸长率),从而根据细胞聚集体的形态对不同亚群的细胞聚集体进行分拣。spheroONE® 为3D细胞模型标准化和自动化处理提供了前所未有的手段。
「简介 」
3D球体因其固有的临床相关性而在高通量筛选中获得了极大的关注(Nunes,2018)。这与实体肿瘤建模尤其相关,因为3D球体具有空间结构、扩散障碍、差异基因表达和耐药性等特征,使其成为抗肿瘤药物筛选的首选模型(Costa,2016)。为了进行可重复的检测,根据球体的大小、形态和内部组织预选球体至关重要。迄今为止,还没有可行的方法来分离和操纵细胞聚集体(Singhera,2017 年)。通过融合关键技术,即精确的纳升体积按需点滴、机器人技术、成像和软件自动化,Cellenion 开发出了用于分拣、分离和点滴3D球体、类器官和类肿瘤体等大颗粒的创新平台--SpheroONE®。本文通过展示我们从异质群体中分离出显示用户定义尺寸和形态特征的球状体的能力,突出了该平台的功能。
「 材料与方法 」
自动大颗粒分离和喷点
在以下实验中使用了一台配备精密纳升体积按需滴定系统(Nano Dispense Capillaries,NDC,约Ø = 400 µm)、光学系统(包括高分辨率相机、暗场照明模块)、x-y-z轴系统和专用软件的spheroONE®仪器。
细胞培养
HEK 细胞在添加 10% FBS 和抗生素(青霉素/链霉素)的 DMEM 中培养。HEK 球形细胞是在超低附着力(ULA)烧瓶(Nunclon sphera,Thermo Fisher)中通过液体覆盖细胞培养制备的,培养过程恒定搅拌(100-150 转/分)3-7 天。培养基每隔一天更换一次。
样品制备
样品(3 毫升)含有 PBS 溶液中的球体悬浮液(500-1500 个球体/毫升),在吸收前对其进行过滤(Uberstrain,70 µm),以去除细小的细胞碎片。在无菌条件下,将滤过的样品装入专用的加压样品容器中,然后转移到spheroONE® 中进行处理。
活/死检测
分离和分配后4小时,通过荧光成像和分析使用 Hoechst33342和碘化丙啶(PI)染色的球体分析来评估细胞活力。
结果与讨论
单球体分离
分离过程示意图见图1。在隔离之前,为确保精确隔离,NDC 被放置在仪器的摄像头前,并执行自动mapping程序。mapping程序(在连续分配液滴的同时,对NDC内部多达100个物体进行约100次跟踪)可精确确定喷射区(图1a),该区域与下一个待分配液滴的体积所填充的区域相对应。为了考虑到在轴运动过程中,喷点毛细管内的颗粒可能会发生沉淀,软件设置了一个沉淀区(图 1a)。mapping完成后,SpheroONE® 执行的分离过程如下(图 1b):(i) 将毛细管置于摄像头前,(ii) 在制作下一个液滴之前采集图像、(iii)对图像进行处理和分析,(iv)软件自动确定下一个液滴是否含有符合用户定义的分离参数的单个球体(在这种情况下,轴系统将 NDC 移到下一个目标孔上方以分配包含球体的液滴然后返回相机前),或者不含有球体(在这种情况下,液滴直接分配到回收管中)
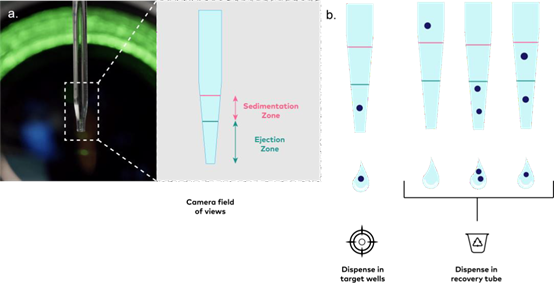
图1

分离过程。a. 纳米喷点毛细管图像及喷射区和沉淀区示意图。b. 分离过程示意图。分离情况:在喷射区检测到单个颗粒,沉淀区无颗粒。丢弃情况:在喷射区未检测到颗粒(左)或在喷射区检测到多个颗粒(中),且在沉积区检测到颗粒(右)。
c. 在暗场照明下NDC中细胞聚集体(白色箭头)的
spheroONE®图像。
为说明分离过程,将HEK球体悬浮液(每毫升PBS中含有500-1500个球体)加载到spheroONE®(图 2a)。样品储存器被加压(约200 mBar),并使用专用程序任务进行系统预处理,以确保管道中充满溶液且无任何气泡。设置检测和分离参数,并执行mapping以确定喷射区。将一个预装了50µL培养基的96U型底孔板放在目标板支架上。开始分离运行,在目标孔板的每个孔中分离和分配单个球体(图2b)。通过设置定义的大小和伸长参数,可对子群体进行排序(图 2c)。
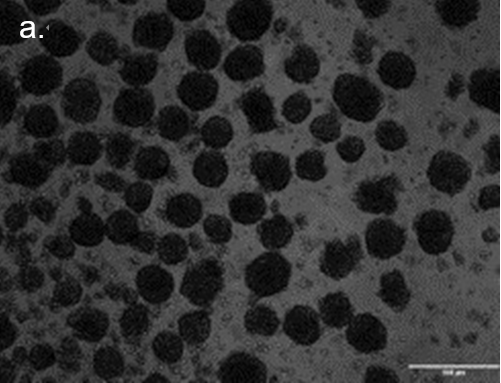
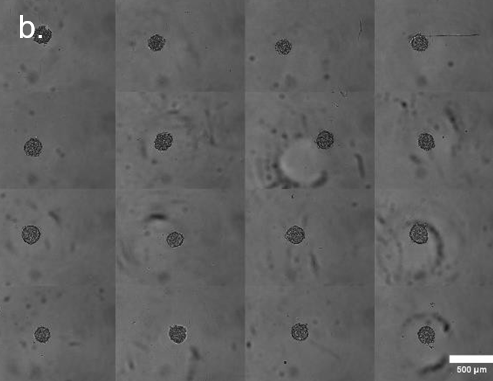
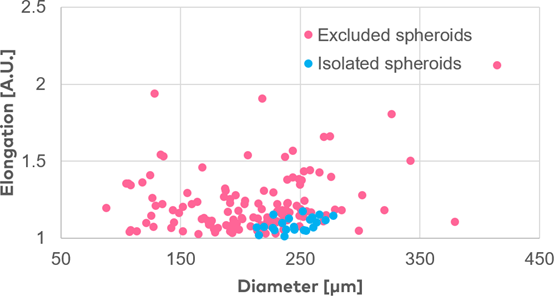
图2
球体分离。a. 分选和分离前球状体悬浮液的显微图像。
b. 分离到单个孔中的球体拼接图像。
c. 分离球体(粉红色点)和排除球体(蓝色点)的大小(直径)和形状(拉伸)的图形表示。(比例尺 = 500µm)。
分离过程具有很高的可重复性,这一点可以从四次独立分离运行中实现的分离准确性看出(图 3)。
平均而言,单个球体的准确率达到 91%(CV < 2%)。
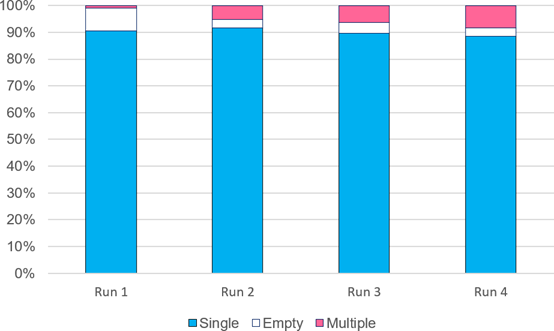
图3
按大小对球体进行分类
为了进一步说明SpheroONE®按大小分离球体的能力,我们使用不同的分离参数进行了多次额外的运行。在第一次分离运行中,分离出直径为100-500 微米的球体。第二次运行使用的参数稍窄,分离出直径为 350-500 微米的最大球体。第三次运行分离出直径为 200-250 微米的较小球体。
分离后,使用明场视野显微镜对球体进行成像,并根据这些图像测量其平均直径。不出所料,第一次分离得到了高度异质的单个球体,测量直径从160微米到 669 微米不等(图 4a、d)。第二次运行成功分离出直径为277至550微米的最大球体(图 4b、d)。第三次实验分离出高度均匀的球体,直径从151微米到 238微米不等(图 4c、d)。显微镜测量的直径与SpheroONE®暗场视野图像之间存在差异的原因是由于光扩散在球体外缘形成光晕,使用暗视野照明时对球体直径产生高估。
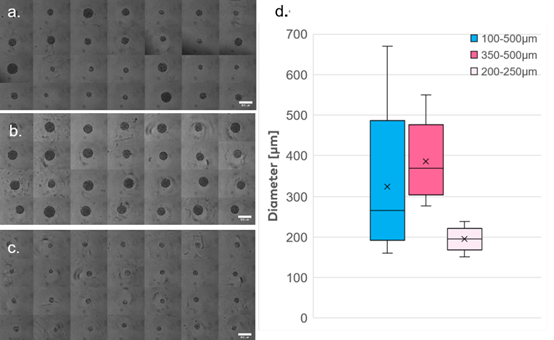
图4
按大小排序的球体。a. 排列好的球体的显微图像,直径范围为100-500微米。b. 排列好的球体的显微图像,直径范围为350-500微米。c. 排列好的球体的显微图像,直径范围为200-250微米。d. 排列好的球体的大小分布的图示。测量是通过使用默认的分割工具从显微图像中进行的。(比例尺 = 500微米)。
分离后的细胞活性
为了评估spheroONE®分离后类球体的活性,在分离后4小时进行了活/死染色(图5)。分离和分装并未损害细胞聚集体的完整性及其活性(图5)。总体而言,细胞存活率超过 97%(图5b)
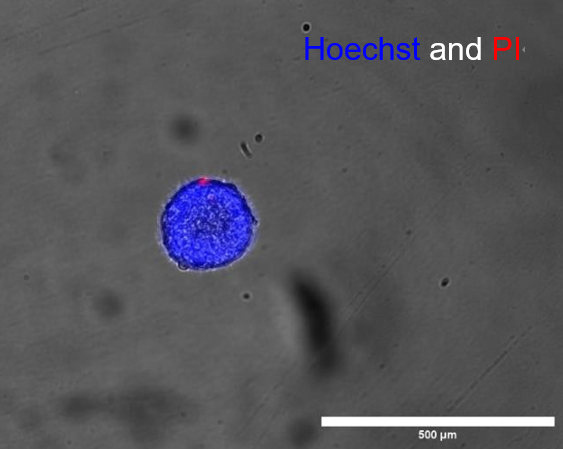
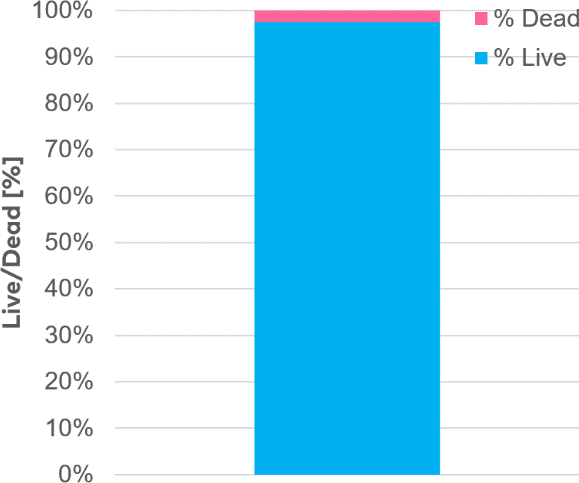
图5
分离后球体的存活率。
a. 分离球体的显微镜图像,用Hoechst和PI染色。
b. 分离球体在分配后4小时的存活率图示。分析显示分离后存活率超过98%。(比例尺 = 500 µm)
结论与未来的方向
研究结果表明,SpheroONE® 平台能够高精度地重复分离单个球体(每孔单个球体高达 92%),并根据用户定义的特征(大小和形状)对其进行分拣。通过使用生存率测定验证了分离后球体的完整性,证明了spheroONE®技术在分选和分离过程中没有损坏这些细胞聚集体或其中的细胞。这些能力展示了该仪器成为推动建立标准化复杂体外3D模型的潜在技术的可能性,这将极大地加速药物发现,并最终减少或取代一些动物实验。
