基因组编辑(Genome Editing)又称基因编辑,是基因工程的一种,指在活体基因组中进行DNA插入、删除、修改或替换的一项技术。其中,CRISPR/Cas9技术是目前基因编辑领域内应用最广的技术,该项技术一经诞生就被人们视为21世纪最为重要的生物发现之一。它稳定高效,已经被全球各地的研究人员应用在各种生物的基因修复、基因改造等技术中。
然而,这一技术从被发现到被广泛应用还不到10年时间。

什么是CRISPR/Cas?
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, 规律间隔成簇短回文重复序列),是存在于细菌和古菌基因组内的⼀段重复序列。
Cas (CRISPR-associated, CRISPR关联)蛋⽩,由总是出现在CRISPR区域附近的CRISPR关联基因编码的蛋白。Cas9是其中一种核酸内切酶,即能从核酸的内部切开双链的酶。
在自然界中,CRISPR/Cas系统能为细菌和古⽣菌提供对病毒和质粒的适应性免疫。现在,科学家通过对这个系统的重新设计和编程,可以精确识别并切断目标DNA,并诱导细胞进行DNA修复,最终实现基因敲除和基因修改。
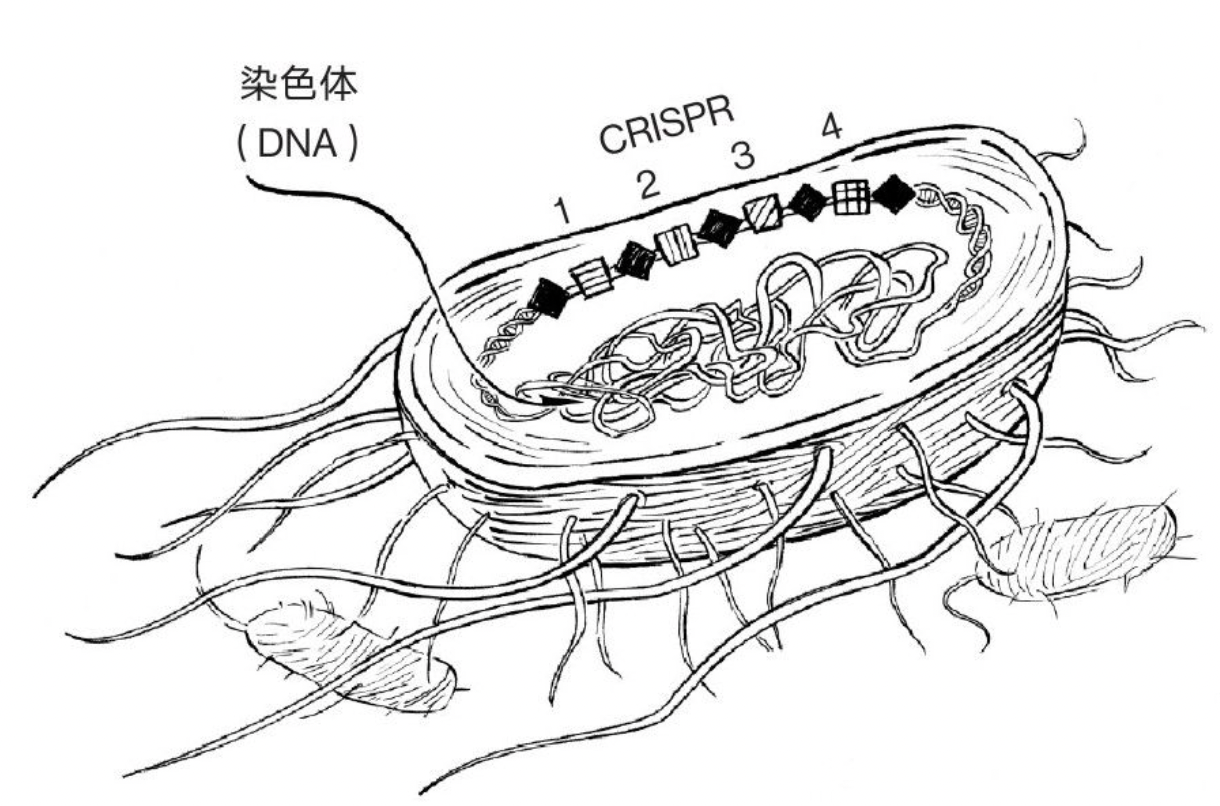
细菌的CRISPR。钻石是“重复序列”,正方形是重复序列之间的“间隔成簇”,钻石与正方形有“规律”地在染色体内密集出现,而不是随机分布。
(图片来自《破天机——基因编辑及其控制演化的惊人力量》)
“发现”的历程
—— 1987年,这种特殊的重复序列被⾸次描述。⽇本大阪大学的科学家⽯野良纯发现⼤肠杆菌基因组DNA上有⼀段重复结构:有⼀段29碱基的序列反复出现了5次,两两之间都被32个碱基形成的看起来杂乱⽆章的序列隔开。
—— 1993,西班牙科学家Francisco Mojica在其他细菌和古菌中发现相似的重复序列,并将其命名为SRSR (Short Regularly Spaced Repeats, 短间隔重复序列)。
—— 2002年,Ruud Jansen及他的同事首次在印刷品中使用CRISPR一词。他们还发现这些序列一般可以在CRISPR相关基因,即Cas基因旁边找到,而Cas基因所编码的蛋白质结构与那些能与DNA发生相互作用的酶的结构很相似。因此,他们推测Cas基因与CRISPR序列存在“功能上的关系”,但这种关系的作用还不清楚。
- 病毒DNA⽚段夹在细菌的重复结构中,就像是细菌在基因组⾥收藏了病毒不同⾓度的快照。凭什么仅靠记录⼀张病毒的快照,细菌就能够防御未来的病毒入侵呢?
- 现在我们知道,细菌在遭到病毒⼊侵后,能够把病毒基因的⼀⼩段存储到⾃⾝DNA中的CRISPR序列。当再次遇到病毒⼊侵时,细菌能够根据存写的⽚段识别病毒,将病毒的DNA切断⽽使之失效。
—— 从1993年到2005年间,Mojica发现,夹在重复序列之间的间隔序列与许多噬菌体(专门⼊侵细菌的病毒)的基因组序列信息⾼度⼀致,提出了CRISPR是细菌的⼀种适应性免疫机制的假设。
—— 2007年,在丹麦丹尼斯克公司(Danisco,世界知名的食品添加剂生产商)⼯作的科学家Rodolphe Barrangou及其团队证明,在嗜热链球菌(⽣产酸奶必须的⼀种益生菌)中⼈⼯添加⼀段CRISPR序列,可以帮助细菌抵挡某种对应病毒的⼊侵。这是首次通过实验证明CRISPR的功能与抵抗噬菌体感染有关。他们还发现,对于嗜热链球菌而言,Cas基因控制了间隔序列的获取与整合,而间隔序列可以特异性地靶向识别再次侵染的噬菌体基因组,因此,他们猜想Cas基因在CRISPR实现的免疫过程中起着重要作用,但其中细节尚不清楚。2008年,荷兰科学家John van der Oost的团队通过在大肠杆菌中的实验证实,小RNA分子协助了细菌抗病毒反应中的识别和摧毁过程,他们称之为CRISPR RNA (crRNA)。同时,他们还通过人为设计相应的crRNA序列使细菌获得了抵抗噬菌体的特性,这是人类首次编辑CRISPR系统。
- CRISPR的RNA分子如何在细胞内产生,并从长链RNA转化成更短的、只包含单一病毒配对RNA的片段?
- 细菌细胞把整个CRISPR序列翻译成一条长RNA链,一种酶把它切成更短的RNA链,它们长度一致,但间隔序列不同。这个过程把DNA中较长的重复序列变成了更短的RNA分子文库,每一个RNA分子都包含一段特定的噬菌体序列。
—— 2008年,美国伊利诺伊州西北⼤学的科学家Luciano Marraffni和Erik Sontheime证明了CRISPR的RNA分子的作⽤对象是DNA⽽⾮RNA,它们是通过碱基配对靶向剪切入侵病毒的DNA。
—— 2010年12月,加拿大拉瓦尔大学的Sylvain Moineau的研究证明了,嗜热链球菌CRISPR/Cas系统靶向锁定噬菌体DNA后,在目标DNA的精确位置,即PAM上游的3个核苷酸处产生双链断裂(double strand break, DSB)。
- 什么是PAM,PAM在CRISPR/Cas系统中起到什么作用?
- PAM(Protospacer Adjacent Motif)是入侵病毒的一部分,但不在细菌CRISPR中出现。如果目标DNA序列后面没有PAM序列,Cas9将不能对目标DNA进行干扰。PAM对靶向识别起着重要作用,它能帮助区分细菌自身和非自身DNA,从而防止细菌本身被CRISPR相关核酸酶锁定和破坏。
—— 2011年3月,瑞典于默奥⼤学的法国科学家Emmanuelle Charpentier领导的实验室在发现,除了crRNA外,还存在第⼆个RNA分子,他们称之为trans-activating crRNA (tracrRNA)。在化脓链球菌中,tracrRNA对于病毒的失活是必需的。tracrRNA与crRNA形成双链体,将Cas9蛋白(当时被称为Csn1蛋白)引导⾄其靶标。
—— 2011年8月,立陶宛维尔纽斯大学的科学家Virginijus Siksnys和丹麦丹尼斯克公司的科学家,在大肠杆菌中重组了嗜热链球菌的CRISPR系统,这种重建的CRISPR系统仍然可以实现对噬菌体DNA的靶向干扰。此外,他们还证明了,对于嗜热链球菌对应的CRISPR/Cas系统而言,Cas9核酸酶是是实现干扰所需要的唯/一蛋白质,这是II类CRISPR系统的显着特征(I类CRISPR/Cas系统中,RNA与多个Cas蛋白结合,形成识别和切割DNA的分子复合体;II类CRISPR/Cas系统则是由单个效应Cas蛋白来发挥功能)。
至此,细菌CRISPR/Cas9系统切割噬菌体DNA的三个核心要件:Cas9、crRNA和tracrRNA皆被发现。
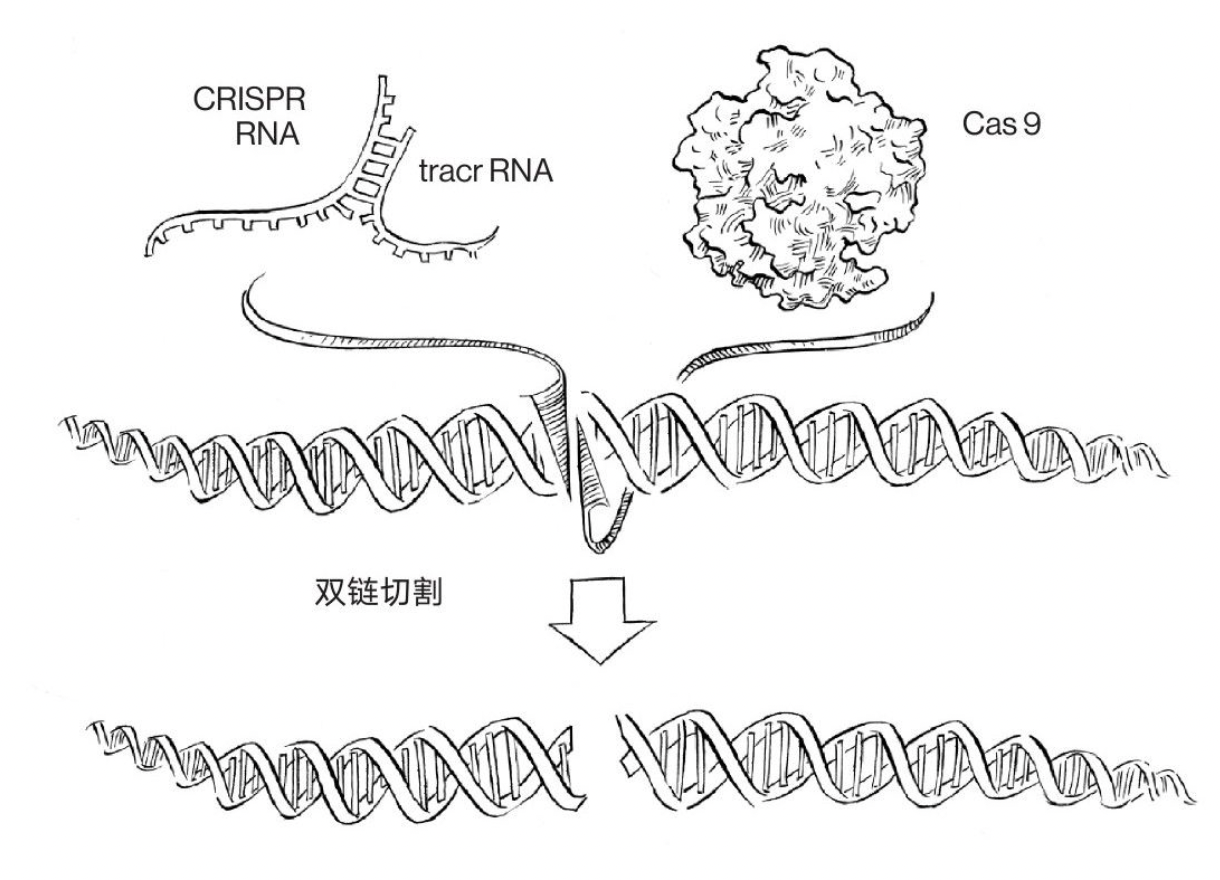
(图片来自《破天机——基因编辑及其控制演化的惊人力量》)
—— 2012年6⽉28日,美国加州⼤学伯克利分校的科学家Jennifer Doudna和瑞典于默奥⼤学的科学家Emmanuelle Charpentier领衔的研究团队合作在Science杂志发表论⽂(2012年6月8日投稿),他们通过体外试验证明,crRNA通过碱基互补配对与tracrRNA形成特殊的双链RNA结构,指导Cas9在靶标DNA上引起双链断裂。团队还将系统所需的两条RNA融合改造成⼀条更加易⽤的单链向导RNA (single-guide RNA, sgRNA),并证明了⼈⼯设计的向导RNA同样可以指导Cas9蛋⽩切割任意指定的⼀段DNA序列。

2020年10月,这两位科学家被授予2020年诺贝尔化学奖,以表彰她们对“基因剪刀”CRISPR/Cas9的贡献。
(图片来自 nobelprize.org)
参考文献
1.王立铭. 上帝的手术刀——基因编辑简史[M]. 浙江: 浙江人民出版社, 2017.
2.[美] 詹尼佛·A.杜德娜、[美]塞缪尔·H·斯坦伯格. 破天机——基因编辑及其控制演化的惊人力量[M]. 湖南: 湖南科学技术出版社, 2020.
