技术服务上新,解锁纳米级原子力显微镜(AFM):纳米尺度生物研究的核心工具及技术服务介绍
你知道吗?在我们肉眼看不到的纳米世界里,DNA的双螺旋在悄悄扭动,细胞表面的微绒毛像小触角一样轻轻摆动,就连病毒颗粒的 “皮肤” 都有独特的弹性 —— 而这些生命的隐秘细节,都逃不过原子力显微镜(AFM) 的 “法眼”。
今天,我们就来聊聊这个能 “看” 能 “摸” 的纳米级神器,以及它如何帮科研人揭开生物世界的微观奥秘。
悄悄说一句:咱们灵赋拓普的技术服务又上新啦!
AFM相关测试现已开放承接
有需要的小伙伴可以
直接拉到文末了解详情哦~
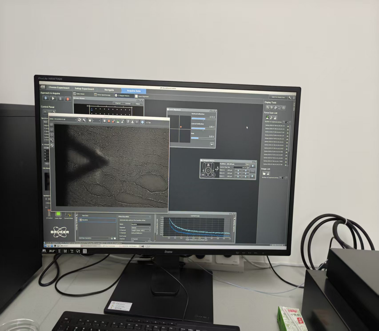
原子力显微镜(AFM)是基于扫描探针技术的超高分辨率成像设备,其核心原理是通过探测探针与样品表面间的微弱相互作用力(如范德华力、静电力等),将力信号转化为电信号,进而重构样品表面的三维形貌。

-
超高分辨率:可达到 0.1 nm 级纵向分辨率,实现近原子尺度的结构观察。
-
多模式成像:
-
-接触模式:利用原子间斥力成像,分辨率高但可能损伤软样品,适用于硬度较高的生物晶体等。
-非接触模式:基于原子间吸引力,对软样品损伤小,适用于细胞等,但分辨率略低。
-轻敲模式:探针高频振动并与样品瞬时接触,兼顾高分辨率与样品保护性,是生物大分子研究的常用模式。
-
环境兼容性:可在大气、液体(接近生理环境)中操作,支持活细胞、生物分子的实时动态观察。
-
多功能集成:除形貌成像外,可同步测量样品的力学特性(弹性模量、粘附力等),为结构 - 功能关联研究提供数据支撑。
-
DNA 研究:可清晰呈现双螺旋结构的周期性特征,捕捉不同离子强度、pH 条件下的构象变化(如舒展、折叠或超螺旋状态),为理解 DNA 复制、转录的结构基础提供依据。

-
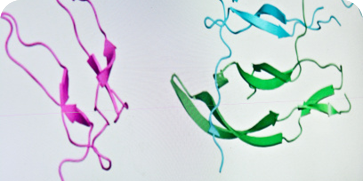
蛋白质分析:在接近生理条件下观察蛋白质的天然构象及动态变化,例如实时监测酶与底物结合前后的结构差异,或肌红蛋白在不同氧分压下的构象转变。
-
分子间相互作用:通过修饰探针与样品表面,可直接观测 DNA - 蛋白质(如转录因子与特定序列的结合位点)、蛋白质 - 蛋白质(如抗体 - 抗原)的相互作用模式,并量化作用力大小,为分子机制研究提供关键数据。

-
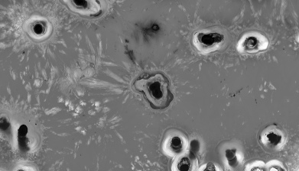
形貌观察:采用轻敲模式可无损成像细胞表面的微绒毛、褶皱等精细结构,通过对比正常细胞与病变细胞(如癌细胞)的表面特征,为疾病诊断提供形态学标志物。
-
力学参数测量:
-弹性模量:通过力曲线模式计算水凝胶或者细胞等的弹性特征,例如心肌梗死区域细胞的弹性模量与正常区域存在显著差异,为心肌疾病的病理机制研究提供线索。

-粘附力:测量水凝胶或细胞与基底间粘附力及粘附能大小,如肿瘤转移研究中,癌细胞与血管内皮细胞的粘附力差异可直接关联其转移潜能。

-
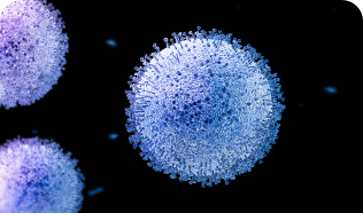
形态与结构分析:AFM 可在近生理环境下清晰成像病毒颗粒的整体形态(如流感病毒的球形结构、表面刺突蛋白),为病毒分类与鉴定提供高分辨率数据。
-
力学特性评估:同步测量病毒外壳的弹性、硬度等参数,例如 HIV 病毒的表面力学特性与其感染能力的关联,为抗病毒药物靶点设计提供新思路。
-
疫苗研发支持:通过监测疫苗病毒颗粒的稳定性及结构完整性,为疫苗质量控制提供量化指标。
-
支架优化:分析生物支架的表面粗糙度、孔隙率等参数,例如骨组织工程中,特定粗糙度的支架可显著促进骨细胞的粘附与增殖,为支架设计提供优化依据。
-
植入体评估:研究植入体(如心脏起搏器电极)表面的化学与物理特性对生物相容性的影响,例如表面亲水性处理可降低炎症反应,提升植入体性能。
-
人工器官开发:模拟天然组织(如血管内膜)的表面结构,指导人工血管的制备,通过 AFM 验证其抗凝血性与细胞相容性。

利用单分子力谱技术研究蛋白质
解折叠过程的分子动力学行为
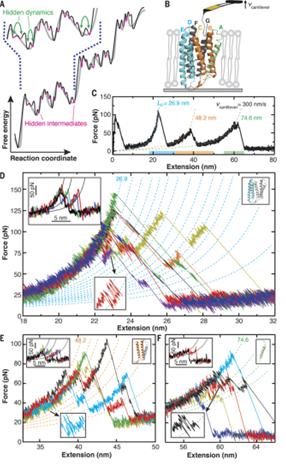
通过精准操控探针与蛋白质分子的相互作用,捕捉蛋白质在解折叠过程中构象变化的力学信号。例如,在研究某些功能蛋白(如分子伴侣蛋白)时,可清晰观测到其在协助底物蛋白正确折叠或应对外界压力(如温度、化学物质刺激 )时,自身结构及与底物作用的动态力学过程,为解析蛋白质折叠异常相关疾病(如阿尔茨海默病中淀粉样蛋白错误折叠机制 )提供关键数据支撑,相关研究成果发表于 Science, 3 Mar 2017, Vol 355, Issue 6329, 945 - 950 。
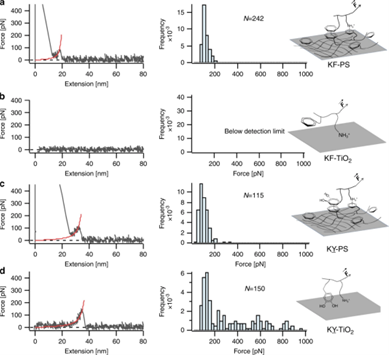
针对不同生物分子界面(如蛋白质 - 核酸、脂质 - 蛋白等界面 ),运用单分子力谱技术,定量测定分子间相互作用的强度数值。通过改变分子结构(如对蛋白质关键结构域进行定点突变、修饰核酸链化学基团 ),系统探究分子结构对相互作用强度的影响规律。比如在研究细胞膜上受体 - 配体相互作用时,明确受体特定结构域的改变如何影响与配体结合的亲和力,助力药物研发中靶点分子的精准设计,相关成果见 Nature Communications volume 11, Article number: 3895 (2020) 。
对于生物医用微纳材料(如纳米药物载体、组织工程支架材料等 ),利用 AFM 结合 hertz 模型,可实现对材料不同区域模量分布的精准测试。以多孔支架材料为例,能清晰获取支架内部孔隙周边、不同材质掺杂区域的模量差异,指导优化材料制备工艺,确保材料力学性能与生物体内环境适配,该方向研究有成果发表于 Nature Communications volume 10, Article number: 4954 (2019) 。
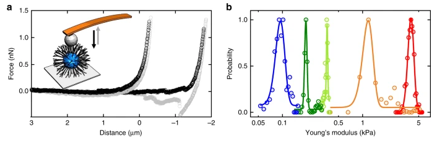
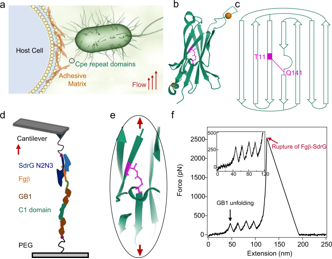
构建病原体(如细菌、病毒 )与细胞表面受体作用的模拟体系,借助单分子力谱技术,模拟生理及病理状态下病原体与细胞的相互作用过程。聚焦于连接蛋白中的酯键,研究其在病原体侵袭、细胞信号传导等过程中对蛋白机械强度的影响,为开发阻断病原体感染的新型药物(如靶向破坏关键酯键作用的小分子药物 )提供理论依据,相关研究成果发布于 Nature Communications volume 12, Article number: 5092 (2021) 。
-
测试内容:三维形貌成像,量化表面粗糙度(Ra、Rq、Rmax)、颗粒尺寸分布、台阶高度、孔洞深度 / 体积等参数。
-
适用样品:细胞、生物膜、细菌、纳米颗粒、生物支架表面等。
-
技术优势:近原子尺度分辨率,支持生理环境下的无损成像,保留样品天然状态。
-
测试原理:通过修饰探针与样品表面,记录分子间作用的力 - 距离曲线,分析相互作用力大小与作用模式。
-
应用方向:DNA - 蛋白质、蛋白质 - 蛋白质、蛋白质 - 多糖等分子间相互作用研究,适用于基因调控、免疫机制等领域。
-
测试参数:基于力曲线模式,采用赫兹模型计算细胞弹性模量;通过探针 - 细胞接触 / 分离过程,测量细胞粘附力。
-
潜在应用:癌细胞与正常细胞的力学特性差异分析、药物对细胞力学的影响评估、组织工程中的细胞 - 支架相互作用研究。
-
测试内容:表征生物材料与细胞 / 组织界面的微观结构(粗糙度、结合方式、物质分布),评估生物相容性、稳定性及降解行为。
-
典型案例:骨植入体与骨组织的界面结合分析、可降解材料的降解过程监测。
1. 样品准备规范
-
样品类型:支持生物大分子(DNA、蛋白质)、细胞(贴壁培养)、组织切片(厚度 10-20μm)、生物材料(块状 / 粉末 / 溶液)等。

-
制样要求:
-
-细胞制备样品:细胞在培养皿中贴壁培养(培养皿规格:直径在35mm-100mm之间),覆盖率最好在 50%-70%左右,不宜过密也不宜过稀。尽量保证都是活细胞,紧密贴壁,减少死细胞及漂浮物影响。可以预先在光学显微镜下观测细胞培养状态,再决定是否进行 AFM 扫图表征。
-组织样品:肿瘤组织,最好是新鲜样本(冰冻切片)直接检测,不需要甲醛固定或者组织透明化 。
-液体 / 粉末样品:需超声分散(默认 5 分钟),分散剂可选水、IPA、酒精等(特殊分散剂需自行处理)。
-
运输注意事项:细胞、组织等易变质样品需冷运(干冰或冷藏),避免剧烈振动。
2. 测试流程
a.样品安装与探针调试:根据样品状态固定(块状用导电胶带,液体用液体池),校准激光与光斑位置。
b.模式与参数设置:根据样品特性选择测试模式(如轻敲模式),设定扫描范围 1μm×1μm 至 100μm×100μm、速率(1-2Hz)及增益参数。
c.数据采集与分析:实时成像并优化参数,扫描完成后用 NanoScope Analysis 等软件处理数据,输出形貌图及量化参数。
